無水酢酸 c 4h 6o 3 = 1021、刺激臭を有する無色の液体。沸点140 oc、密度 108、水に難溶。 水と徐々に反応して酢酸になる。 酢酸ナトリウム c 2h 3o 2na = 981、無色の結晶。吸湿性で水に可溶。 アセトアニリド oc 8h 9no = 135:無色板状晶(水から再結晶)、融点113基,oh基のhをアセチル基ch 3 coで置換する反応をいう.一般に,無水酢酸 または塩化アセチルを用いて行われる.第三級アルコールのようにアセチル化されにくいものは,酸を触媒にしてケテンを作用させると収率がよい.芳香環のアセチル化には,塩化アルミニウム,ルイス酸などの触媒がアセチル化 哲猫 07 年10 月23 日 アルコールroh (またはフェノール類) やアミンrnh2 に、塩化アセチルch3cocl や無水酢 酸(ch3co)2o を働かせると、アセチル基を導入することができる。 尚、酢酸もアセチル化試薬になり うるが、その働きは塩化アセチルや無水酢酸よりも劣る(カルボニルの炭素原

イソニトリルの合成 アニリン クロロホルム 水酸化ナトリウムを加熱して生 Okwave
アニリン 無水酢酸 反応機構
アニリン 無水酢酸 反応機構- 最後に、アニリンと無水酢酸からアセトアニリドを生成するときの反応機構を示して、少し解説します。 反応機構は以下の通りです。 少し上の反応機構を説明する前に、補足的な説明をします。 まず、Phですがフェニル基を表しています。フェニル基とはサリチル酸は、示性式 oc 6 h 4 (oh)cooh で表される物質で、ベンゼンのオルト位にヒドロキシ基とカルボキシ基が結合した構造をしています。 防腐剤、医薬品など身近に用いられる重要な物質の一つです。 このページでは、サリチル酸の構造・性質・製法・反応について説明しています。
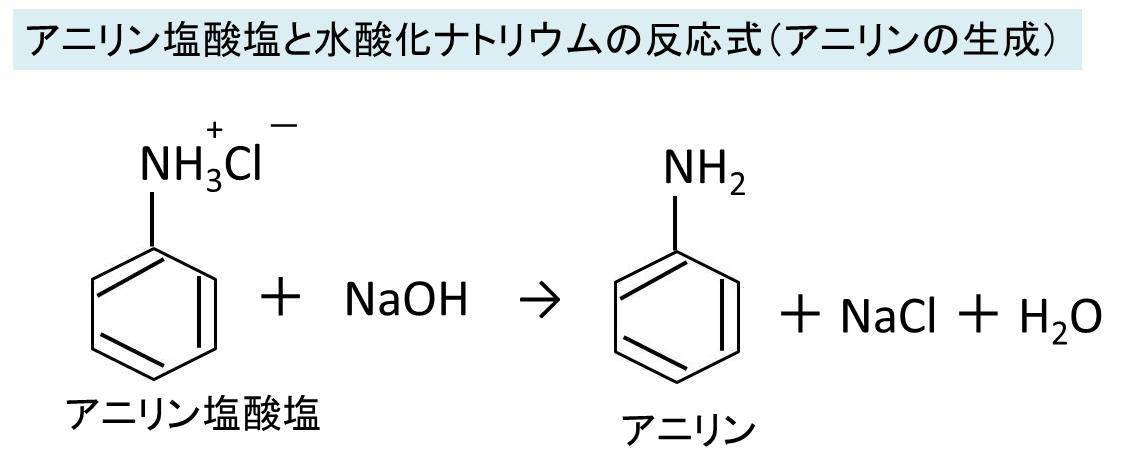



アニリンと塩酸の反応式 アニリン塩酸塩生成 やアニリン塩酸塩と水酸化ナトリウムの反応式
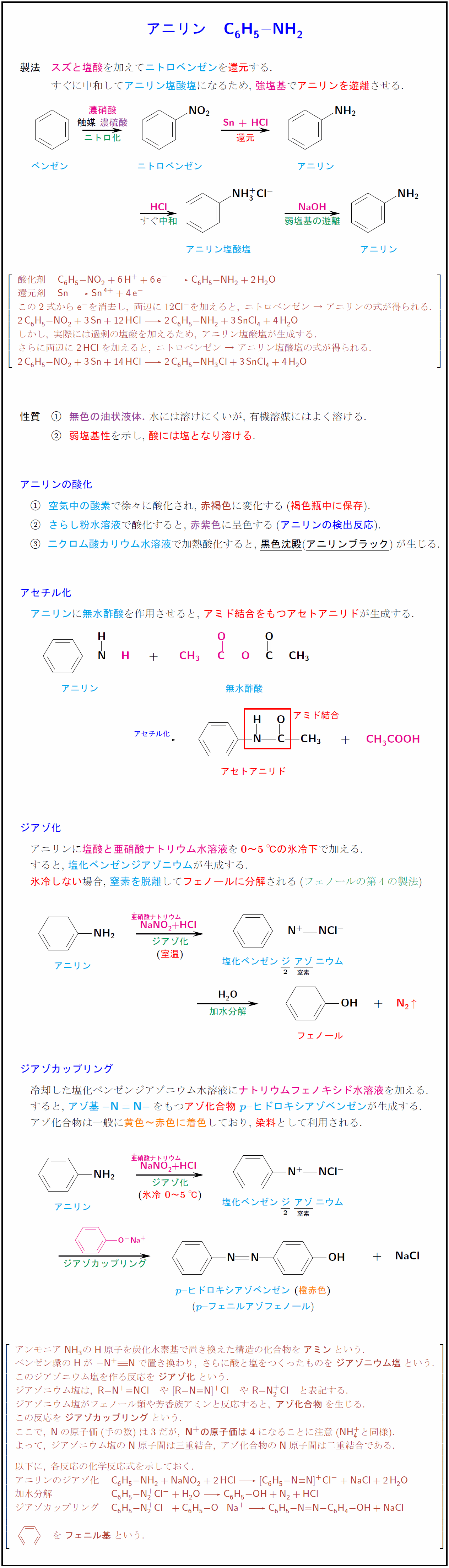
概要 アニリン塩酸塩は弱塩基であるアニリンと塩酸の塩であり、先に述べたようにアニリンと濃塩酸を反応させると得られる。 また、実験室的なアニリン生成法としてニトロベンゼンをスズと塩酸によって還元する方法があるが、この際に、生じたアニリンと過剰の塩酸とが反応して一時 無水酢酸ナトリウムも反応機構に書く必要はあるのでしょうか。 酢酸ナトリウムを加えるのは、アニリン塩酸塩からアニリンを遊離させることが目的です。常識的に考えてこの部分の反応機構まで書く必要はないでしょう。 すなわち、 c6h5nh3cl ch3coona → c6h5nh2 ch3cooh3) それらがくっついて酢酸ch 3 coohとなって 4) サリチル酸と無水酢酸が切れて残った断片がお互いくっついて、アセチルサリチル酸になる。 と読むしかなさそうです。 でも実際はこの反応ではそんな都合良くブチブチ切れる反応は起こっていません。
反応機構についてだが、反応は無水酢酸が AlCl3と反応して求電子試薬であるアシルカチ オンを生成することから始まる。いったん生成したアシル 検索ワード入力 閉じる 検索ワード削除 検索 menu FriedelCrafstアシル化反応によるpアセチルトルエンの合成 会員550円 l 非会員660円; 無水酢酸を使ったエステル化 無水酢酸は最もよく使われる酸無水物です。ohやnh 2 などの保護に使われることが多いです。 アセチル基は塩基・ヒドリド還元には弱いですが、酸にはある程度耐えます。 反応は簡単で無水酢酸を溶媒とします。また、触媒に求核アシル置換反応(きゅうかくアシルちかんはんのう、nucleophilic acyl substitution、NAS)は、あるアシル化合物が求核剤と反応して別のアシル化合物に変わる置換反応。 アシル化合物はカルボン酸の誘導体で、エステル、アミド、カルボン酸ハロゲン化物、カルボン酸無水物など。
酢酸ナトリウムを加えると平衡反応で、アニリンと酢酸が発生する(式2)。 発生したアニリンは、水溶液中の無水酢酸とすぐに反応してアセトアニリドになる(式3)。 Title 化学系基礎実験(有機化学)予習テキスト Created Date AMFriedelCrafts 反応の反応機構 中 根 良 平 * Mechanism of FriedelCrafts Reaction Ryohei NAKANE * 1 は じめ に 1877 年, CFriedel と JMCrafts によって見出さ れた FriedelCrafts 反応は有機合成上非常 に応用の広 い反応である。その典型的なものとしては無水塩化アル ミニウムを触媒とするアルキル化反応,ア シル化 無水酢酸ナトリウムも反応機構に書く必要はあるのでしょうか。 お手数ですが、教えてくださると助かります。 締切済み 化学;



芳香族アミン アニリン の構造 製法 性質 反応 化学のグルメ




アゾカップリングは染料を合成する工業的化学反応 とらおの有機化学
無水酢酸 pMethylacetophenone 実験 3B FriedelCraftsアシル化反応 E E H Nu E HNu E H Nu E H Nu H 芳香族求電子置換反応 芳香族性の回復 芳香族性の一時的な喪失 置換生成物 付加生成物 ブロモ化 ニトロ化NO アルキル化 アシル化 Br 2 R RCO E 求電子剤 求電子剤の生成 O O O AlCl 3 O O Al Cl O Cl Cl O O Clチル酸と無水酢酸を硫酸触媒により反応させアセチルサリチル酸を合成した。精製物の赤外吸収 スペクトルを調べたところアセチルサリチル酸が合成されていて、収率は435 %であった。また、サ リチル酸とメタノールを反応させサリチル酸メチルも合成したが、この薬品は消炎外用薬としてアニリンから pニトロアニリンの合成 アニリンのアミノ基をアセチル基(CH この溶液を約50 ℃に温めてから3、無水酢酸15 mL (比重 10 )を加え、さっとかき混ぜ、直ちに4これを酢酸ナトリウム溶液5に注ぎ込む。ガラ ス棒でよく撹拌しながら、5分間、室温で反応させた後、氷水浴で冷却




Wo05 0905号 微生物及び微生物由来酵素によるアニリン誘導体のアセチル化 Astamuse



Research A Of Organofluorochemlab
アニリン 無水酢酸 反応機構 アニリン 無水酢酸 反応機構酢酸、ナフタリン、カンファ、グリセリン、テレビン油、アルコール類、一般還元性 物質 無水ふっ化水素酸 アンモニア (含水、あるいは無水) 硝酸 (濃) 酢酸、アニリン、クロム酸、シアン酸、硫化水素、引火性液体、引火性ガス 無水酢酸の代わりに酢酸を用いるとアセトアニリドの収率が大きく下がる理由が知りたいです。 アセトアニリドの合成で収率を求めたら42%になりました。 こうゆうのはありなんですか、、? 50gのアニリンに十分な量の無水酢酸を反応させたところメチルエーテル→酢酸メチル→無水酢酸の,逐 次反応で 進むものであり,Luftら29)に より実験的に確認された (図2)。 反応機構に関していくつかの報告がなされている。 筆者ら30)は,反 応速度に対する酢酸 リチウムおよびヨ ウ化メチルの影響を調べた。その



n ニトロソアニリン誘導体 並びに それを用いた高反応性ros発生剤及び高反応性rosの発生方法




アニリンと塩酸の反応式 アニリン塩酸塩生成 やアニリン塩酸塩と水酸化ナトリウムの反応式
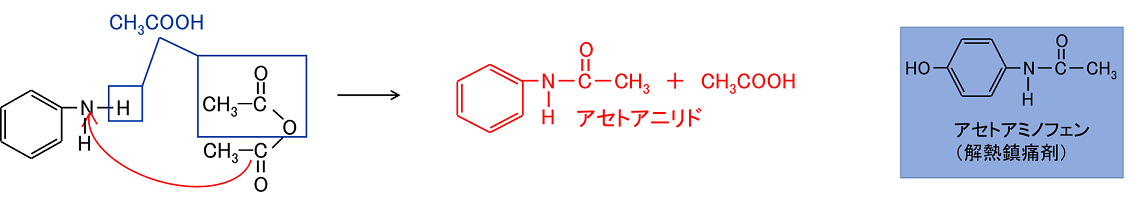
アニリン、濃塩酸、無水酢酸、無水酢酸ナトリウム、活性炭 3 方法 (1) 300mlのビーカーに135mlの水を入れる。これに45mlの濃塩酸を加える。 (2) これに5gのアニリンを加え、ビーカーを振りながら混ぜ合わせる。 (3) もしこの溶液が着色していたら、1gの活性炭を加え、かき混ぜたあと、ろ過をする 反応機構について一言で説明すると、「ある反応がどのようにして起こっているかを電子の動きで表現したもの」です。) この反応では、無水酢酸のカルボニル基が、サリチル酸の oh 基を引き寄せ、酢酸を追い出します。これまでの例では、カルボン酸から水分子が追い出される反応で目的 アニリンと無水酢酸との反応により,アセトアニリドが生成すること(アセチル化反応)を学 ぶ.また,その収率を求める. 解説 1.アセトアニリド 人工的に作られた最初の合成解熱剤がアセトアニリドであり,以前はアンチフェブリン (Antifebrin)の名称で呼ばれた.1853年に仏の



カルボニル化合物 カルボン酸誘導体
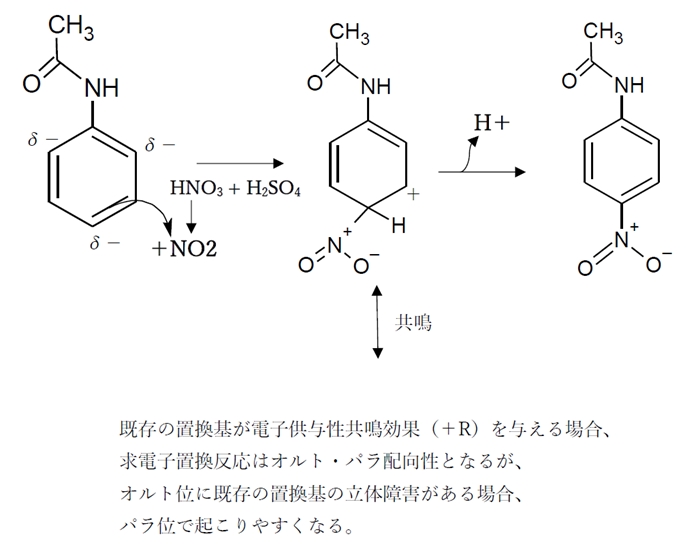



薬学 芳香族求電子置換反応 薬剤師国家試験過去問題105回問104
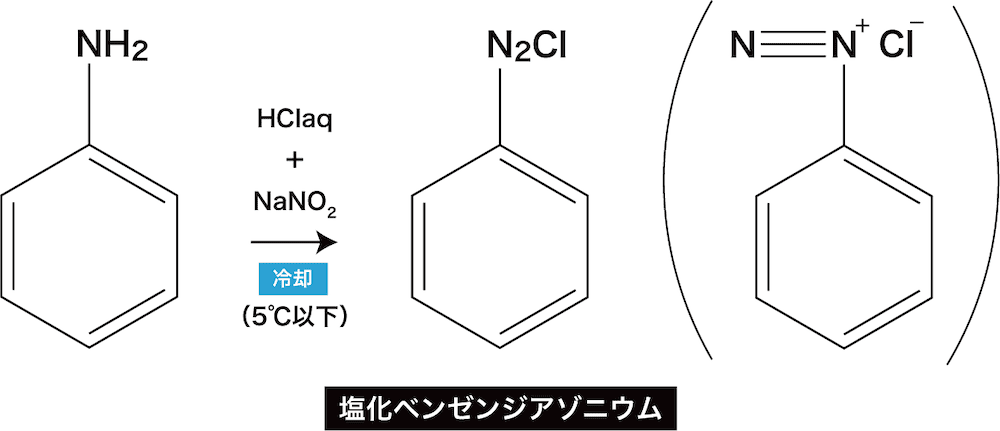
酢酸と無水酢酸(分子内脱水反応) 無水酢酸は二分子の酢酸が結合した物質。 上図のように一分子の水が放出される。 無水酢酸のように、二分子のカルボン酸(二個のカルボキシ基)が結合して一分子の水が消えた物質を酸無水物という。酸無水物はもはや酸ではなく中性で、無水酢酸も中性酸無水物とエポキシドの硬化反応における種々の置換酸無水物の反応性及び開環反応機構の解析 環反応が律速反応(0次)に なった場合は,各酸無水物の 反応性は大差ない結果が得られたことから,酸無水物の 開環反応機構を以下のように推察した pdfアニリンが無水酢酸と反応したときの変化を化学反応式で示すと, C 6 H 5NH 2 +(CH 3 CO) 2 O→C 6 H 5NHCOCH 3 +CH 3 COOH アニリンブラックは,古くは繊維の染色に利用された。アニリンの酸化縮合によって得られる。日光,洗濯,漂白などによって変化しにくく,安価で実用価値の高い




Wo05 0905号 微生物及び微生物由来酵素によるアニリン誘導体のアセチル化 Astamuse




添加剤でスイッチするアニリンの位置選択的c Hアルキル化 Chem Station ケムステ
アニリンの反応 アニリンは、酢酸や無水酢酸と反応して アセトアニリドになります。 これはアセチル化の一種ですが エステル化では アニリンアセチル化反応機構, アニリン アニリン (aniline) はベンゼンの水素原子の一つをアミノ基で置換した構造を持つ、芳香族化合物のひとつ。 アニリン
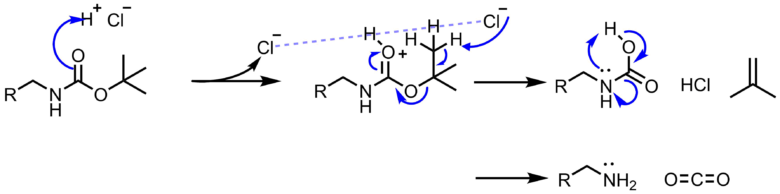



Boc基の保護 脱保護条件と反応機構 ネットdeカガク




アセトアミノフェン Wikiwand



ニトロアセトアニリドの脱保護について教えてください 実験のレポー Yahoo 知恵袋




教えてください お願いします Clearnote



研究内容紹介



2



1




アニリンの性質とアニリンの反応を徹底的にまとめてみた 化学受験テクニック塾



アミノ基とヒドロキシ基の求核性 無水酢酸とヒドロキシアニリン反応 92



1



ほんとは簡単 ジアゾ化 カップリングを解説 受験メモ




有機反応を俯瞰する ー縮合反応 Chem Station ケムステ



1



第137章 医薬品
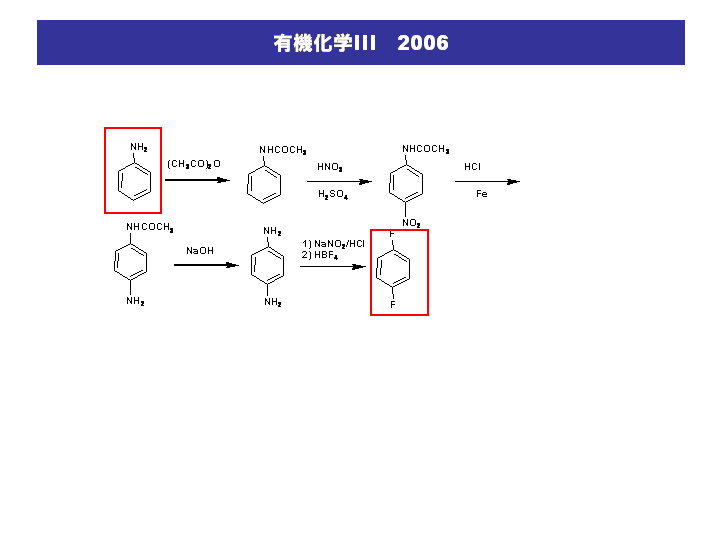



神大工応化 有機化学iii




アシル化 Wikipedia




求核アシル置換反応 Wikipedia



有機反応機構 カルボン酸とその誘導体の反応




Dr Stone 漫画アニメ 化学 サルファ剤 すべての反応式 さ助ブログ




サリチル酸の構造 性質 製法 反応




17 号 レバプラザン塩酸塩の調製方法 Astamuse



有機立体化学対策講座 第八回 酢酸エチルの酸塩基触媒下における加水分解反応



芳香族アミンとジアゾ化合物




アゾカップリングは染料を合成する工業的化学反応 とらおの有機化学



コレクション アニリン 無水酢酸 反応 アニリン 無水酢酸 反応機構



第137章 医薬品




Wo05 0905号 微生物及び微生物由来酵素によるアニリン誘導体のアセチル化 Astamuse
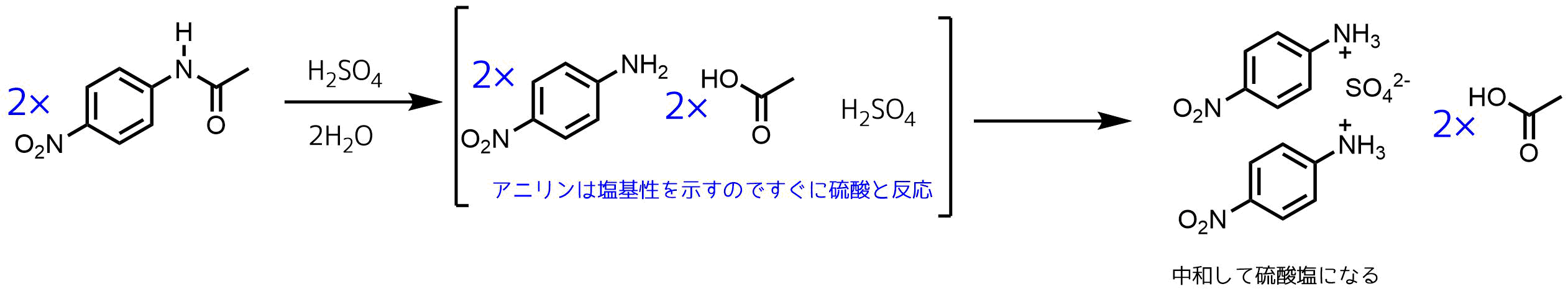



ニトロ化反応の条件とやり方 ネットdeカガク




有機反応を俯瞰する ー縮合反応 Chem Station ケムステ




4 ジメチルアミノピリジン Wikipedia



2




高等学校化学i 芳香族化合物 アニリンとアゾ化合物 Wikibooks



4k有機化学 章末問題こたえ
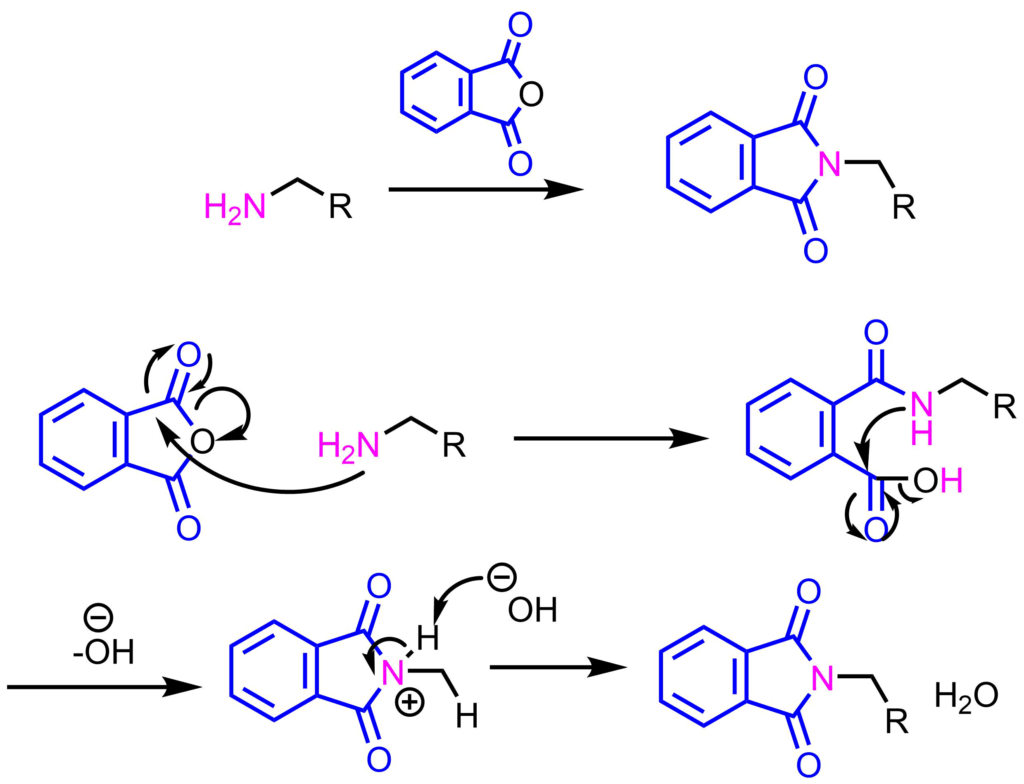



フタロイル Phth 基によるアミンの保護 ネットdeカガク
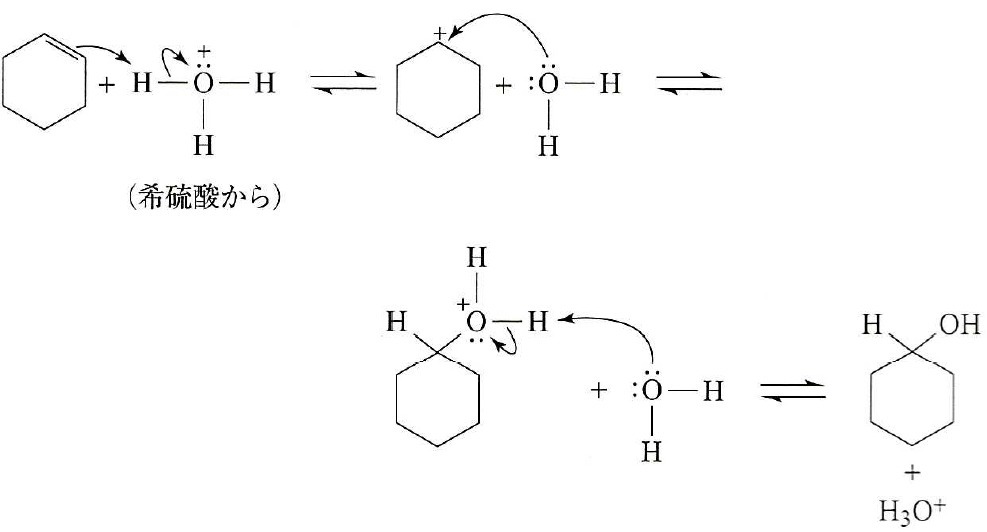



メチルシクロヘキサンと硫酸 水の反応機構 画像のメチルシクロヘキサンと硫 Okwave



4k有機化学 章末問題こたえ




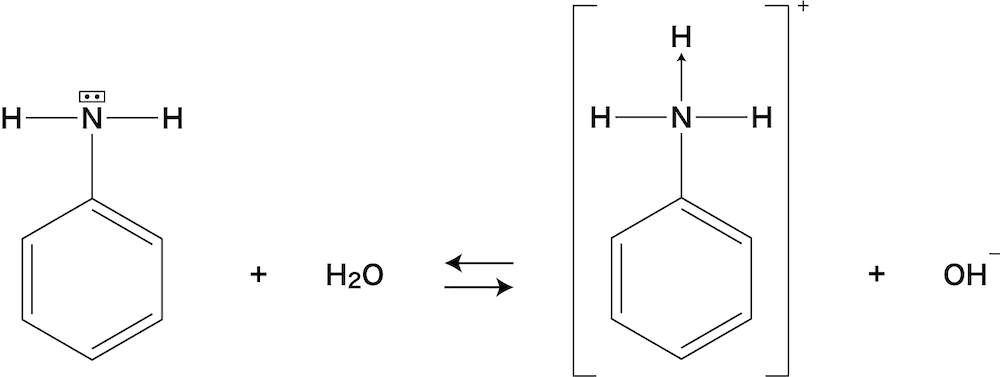
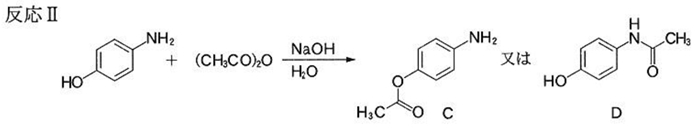
2 3 アニリンと酢酸の反応




アセチル化について教えてください ある物質をアセチル化するのに無 化学 教えて Goo




芳香族化合物の配向性と反応性 オルト メタ パラの配向性 リョースケ大学
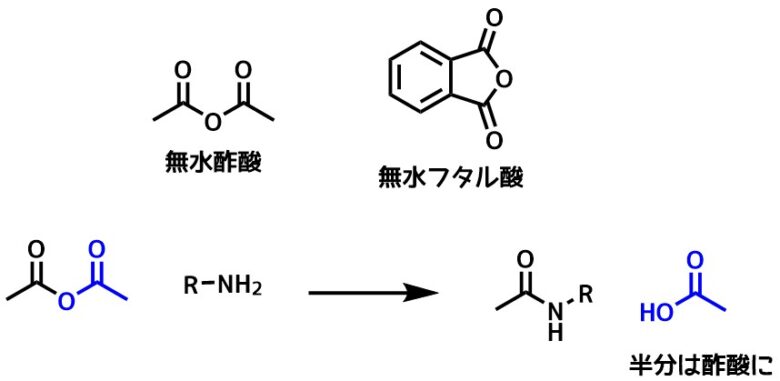



アミドの合成方法まとめ ペプチド結合は安定性の高いアミド結合 ネットdeカガク




高等学校化学i 芳香族化合物 アニリンとアゾ化合物 Wikibooks




イソニトリルの合成 アニリン クロロホルム 水酸化ナトリウムを加熱して生 Okwave




有機反応を俯瞰する ー縮合反応 Chem Station ケムステ



第137章 医薬品



n ニトロソアニリン誘導体 並びに それを用いた高反応性ros発生剤及び高反応性rosの発生方法
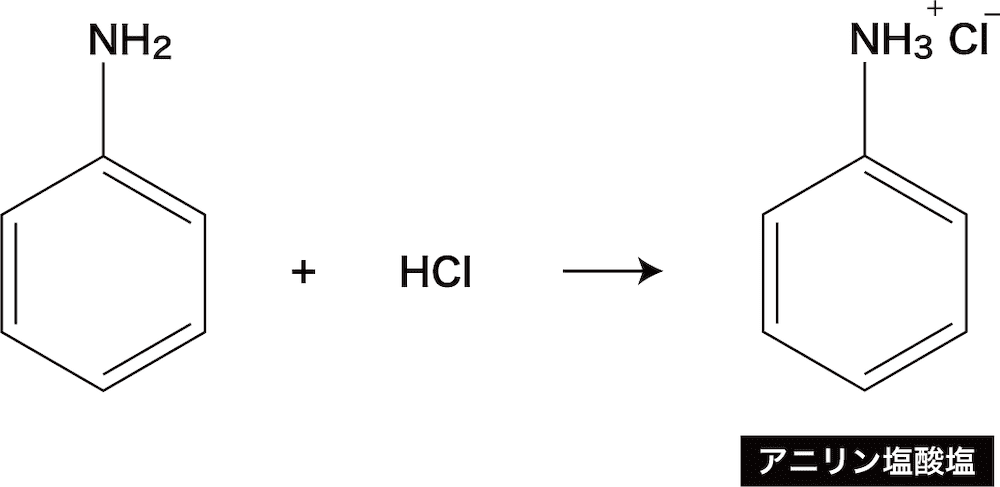



芳香族アミン アニリン の構造 製法 性質 反応 化学のグルメ



芳香族アミン アニリン の構造 製法 性質 反応 化学のグルメ
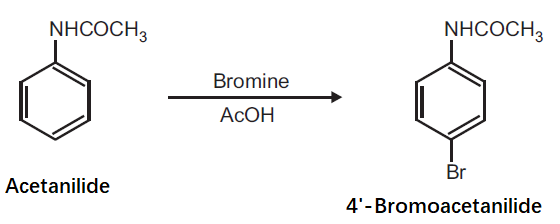



4 ブロモアセトアニリド 103 8



高校有機化学 アニリン C H Nh の製法 酸化 アセチル化 ジアゾ化 ジアゾカップリング 受験の月



2



放課後化学講義室 高校の有機化学は化学的でない



窒素を含む芳香族化合物



環化 問6



1




ニンヒドリン反応の利用法と反応機構




酢酸エチル Wikipedia



アニリン 合成 アセトアニリドの反応機構を示せ という課題に対して画 Yahoo 知恵袋



2




添加剤でスイッチするアニリンの位置選択的c Hアルキル化 Chem Station ケムステ



学位論文要旨詳細




高校化学 アニリンと無水酢酸の反応 映像授業のtry It トライイット




アセチル化について教えてください ある物質をアセチル化するのに無水酢酸 Okwave



特許 知財ポータル Ip Force



4k有機化学 章末問題こたえ




高校化学 アニリンと無水酢酸の反応 練習編 映像授業のtry It トライイット



B1v6 Rf8erv55m
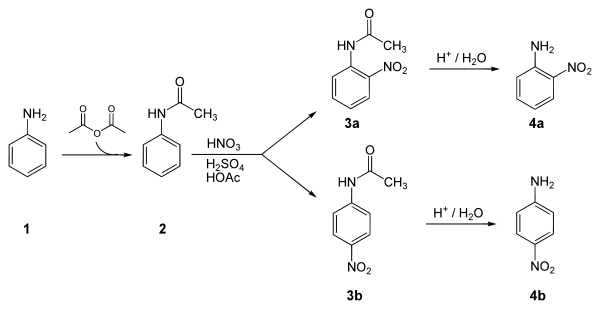



4 ニトロアニリン Wikipedia



アセチル酸 無水酢酸の反応の中間体の名前が知りたいです どう調べれば良 Yahoo 知恵袋



アセトアニリドをニトロ化する際 固体のアセトアニリドに濃硫酸 Yahoo 知恵袋
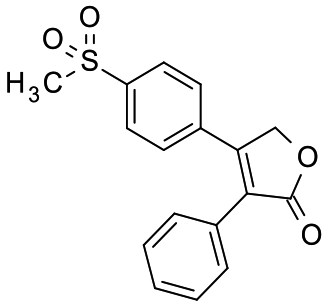



1611 90 7 ロフェコキシブ Rofecoxib 186 詳細情報 ライフサイエンス 試薬 富士フイルム和光純薬
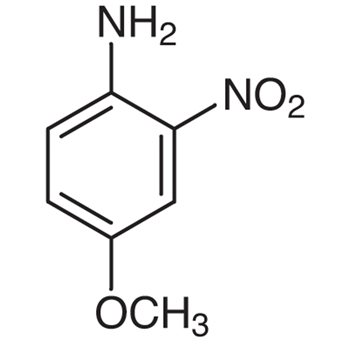



4 Methoxy 2 Nitroaniline 96 96 8 Tokyo Chemical Industry Co Ltd Apac




ホフマン転位 Hofmann Rearrangement の反応機構 アミドからアミンの合成 Youtube



2




高校化学 アニリンと無水酢酸の反応 映像授業のtry It トライイット



Research




女子高生と学ぶエステルの加水分解と脱水縮合の反応機構 有機化学論文研究所
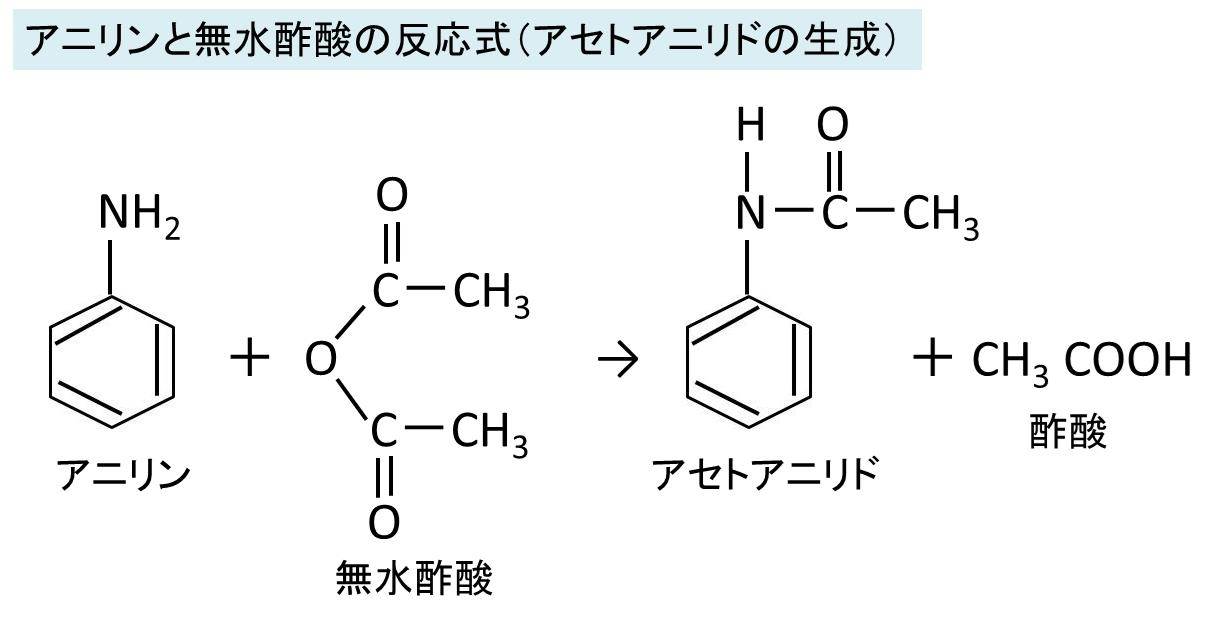



アニリンと無水酢酸の反応式 アセトアニリド生成 酢酸を使用しない理由は



第137章 医薬品



1




名城大学理工学部応用化学科 永田研究室 有機化学演習 第8回疑問点など




高校化学 アニリンと無水酢酸の反応 練習編 映像授業のtry It トライイット



2




高校化学 アニリンの製法 映像授業のtry It トライイット



芳香族アミンを網羅的に解説 受験メモ



5 3 1 医薬品



n ニトロソアニリン誘導体 並びに それを用いた高反応性ros発生剤及び高反応性rosの発生方法




有機反応を俯瞰する ー縮合反応 Chem Station ケムステ




3ページ目 第105回 構造生物薬学




50 アニリン 無水酢酸 反応機構 アニリン 無水酢酸 反応機構 Mbaheblogjpasjf




アセトアニリドの合成 アセトアニリド 再結晶 Tlc 薄層クロマトグラフィー 融点測定 Transblog




アニリンのニトロ化 アニリンをニトロ化する際 直接ニトロ化するので 化学 教えて Goo



有機反応機構 カルボン酸とその誘導体の反応
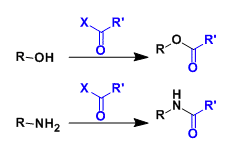



アシル化試薬 合成 材料 製品情報 試薬 富士フイルム和光純薬




名城大学理工学部応用化学科 永田研究室 有機化学演習 第10回疑問点など



0 件のコメント:
コメントを投稿